iNature
肿瘤细胞中PD-L1表达的增加促进了免疫逃避。然而,PD-L1在例胰腺导管腺癌(PDAC)细胞中的表达调控机制仍未完全阐明。
2025年2月7日,浙江大学丁元及王伟林共同通讯在Gastroenterology(IF=25.7)在线发表题为“The Moonlighting Function of GLS2 Promotes Immune Evasion of Pancreatic Ductal Adenocarcinoma by TTLL1-mediated YAP1 Glutamylation”的研究论文。该研究表明GLS2的兼职功能通过TTLL1介导的YAP1谷氨酰化促进胰腺导管腺癌的免疫逃避。研究结果表明,缺氧诱导的GCN5介导的GLS2在K151的乙酰化,增强了GLS2与YAP1的相互作用。随后,微管蛋白酪氨酸连接酶样1(TTLL1)在E100介导YAP1谷氨酰化,并促进其核转位和PD-L1表达的激活依赖性转录上调。
PDAC细胞中GLS2-K151R或YAP1-E100A突变体的表达阻断了低氧诱导的PD-L1表达,增强了CD4+和CD8+ T细胞活化和肿瘤浸润,从而抑制了PDAC肿瘤生长。同时给予MB-3(一种GCN5抑制剂)和抗PD-1抗体可消除肿瘤免疫逃避,增强免疫检查点阻断的抗肿瘤功效。此外,在PDAC患者中,GLS2- K151乙酰化和YAP1 E100谷氨酰化水平与PD-L1表达和不良预后呈正相关。该研究揭示了缺氧上调PD-L1表达的新机制,并强调了GLS2参与肿瘤免疫逃避的非规范代谢途径,这对于PDAC治疗具有意义。

抗PD-1/PD-L1疗法在各种癌症类型中表现出有希望的临床结果,包括胰腺导管腺癌(PDAC)。然而,对这种疗法的耐药性,包括原发性、适应性和获得性,在实体瘤中普遍存在。PDAC具有免疫抑制性,其免疫检查点的突变会显著影响预后。在PDAC,免疫疗法的疗效与其肿瘤微环境密切相关,缺氧是影响治疗反应的关键因素。尽管如此,精确的潜在机制仍有待完全阐明。
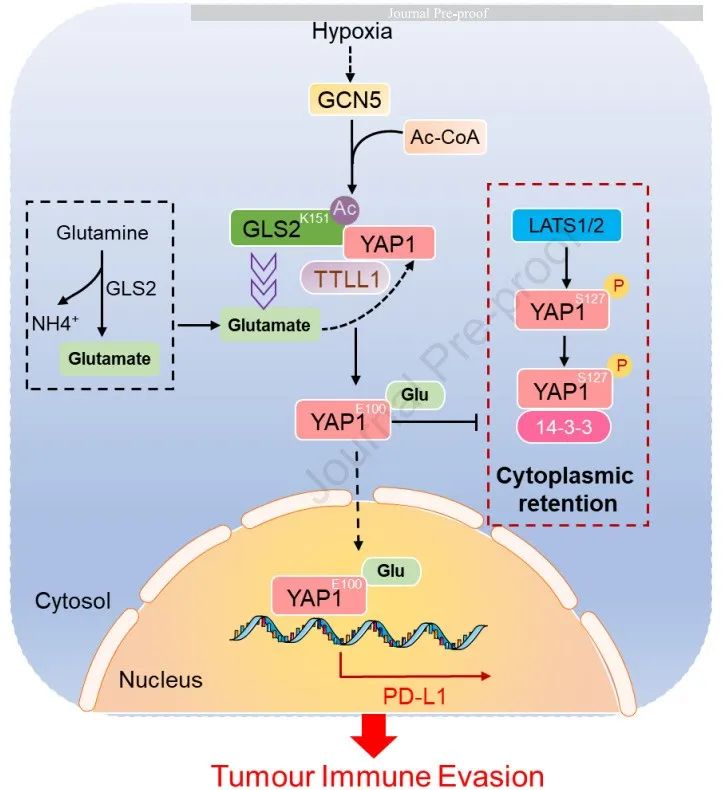
机理模式图(图源自Gastroenterology)
在该研究中,研究人员揭示了PDAC免疫逃避背后的分子机制,以改进治疗策略。研究证明缺氧诱导GLS2在K151的GCN5依赖性乙酰化,增强GLS2和YAP1之间的相互作用,导致YAP1在E100的谷氨酰化。因此,YAP1 易位进入细胞核,促进PD-L1表达,并赋予PDAC细胞存活和免疫逃避能力。总之,该研究揭示了PD-L1上调的一种新机制,该机制由PDAC的GCN5–GLS2–TTLL1–YAP1轴控制。该研究还为提高PDAC靶向治疗和PD-1/PD-L1阻断治疗的临床反应率和疗效提供了分子理论基础。
参考消息:
https://www.gastrojournal.org/article/S0016-5085(25)00357-9/abstract#au14
来源:iNature
- 随机文章
- 热门文章
- 热评文章
- 正式接入DeepSeek!丰泽自助政务服务助手小丰更智能、更高效!
- 法治进校园,学法促成长江油市文化街小学2025春季开学第一堂法
- 春起珠江繁花盛,花城花开齐相邀——第60届全国仿真植物及配套
- 以开门红推动全年好——聊城房地产业和建筑业高质量发展今
- 会议通知|中华中医药学会第二十六次中医肝胆病学术会议今日
- 国家能源集团官网删除拟录用公示名单引关注,官方通报:3名本科
- 今日科普|为何手放电磁炉上,不会烫
- ExcavatorManufacturerOperatesatFullCapacitytoFulfil














 京公网安备11000000000001号
京公网安备11000000000001号 京ICP备11000001号
京ICP备11000001号